水处理基本知识 超纯水的极限电阻率为什么是18.3MΩ*CM
随着超纯水应用范围越来越广,超纯水的基本概念越来越被大家熟知,其核心指标为25℃时,电阻率R>10MΩ*cm,更有甚者动辄要求电阻率不小于18.2MΩ*cm,非常接近超纯水电阻率极值R=18.3MΩ*cm。
备注:
电阻率公式中常用希腊字母ρ(读音rou)表示,亦可用R表示。
电导率公式中常用希腊字母σ(读音Sigma)表示,亦可用G表示,R*G=1。
G≤1μs/cm时一般以电导率表示水导电性,反之则以电阻率R表示,此时R≥1MΩ*cm。

那么超纯水的极限电阻率18.3MΩ*cm又是怎么得来的呢?是理论极限还是工艺限制呢?
首先我们需要知道其数值18.3为理论极值而不是工艺极值,还需要有一个前提就是在25℃状态下。也就是说,在25℃状态下,我们能得到超纯水电阻率只能无限接近于18.3MΩ*cm,而不管今后工艺如何改进都无法超过其值。
而需要定义25℃的前提的主要原因,溶液的电导率和温度成正相关,也就是电阻率与温度成负相关。随着温度的增加的,溶液的电阻率也会相应的降低。
在超纯水状态下,可以理解为溶质[部分电离的水分子,KW(电离常数)=1.0*10-14]溶解在水溶液中。也就是说当温度超过25℃时,超纯水电阻率理论极值低于18.3(不影响理解的前提下省略单位,下同),关于温度对电导率,电阻率极值的影响,放在文末细化讨论。
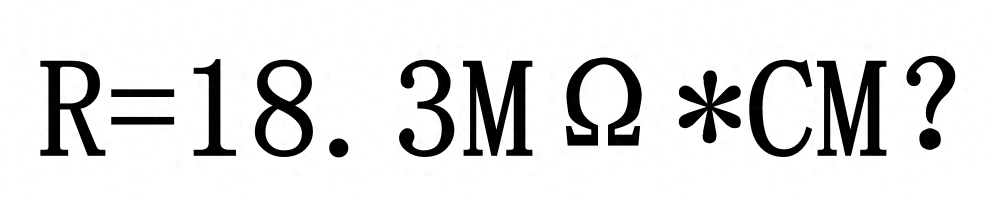
那么超纯水电阻率理论极值又是如何计算出来的呢?
在超纯水极限状态下,溶液中除H20组成以外的物质都得到了100%去除,但是水作为很弱的电解质会存在着无法避免的自身电离平衡:
H20⇋(H+)+(OH-),更精准的表达应该为2H2O⇋(H3+O)+(OH-)
备注:后式的表达更符合实际的电离平衡,也跟实际测量得到的氢离子极限摩尔电导率大于氢氧根离子极限摩尔电导率符合,此处写了一段又删了,偏题了哈哈。
KW(电离常数)=1.0*10-14,KW=[H+]*[OH-],
所以[H+]=[OH-]=1.0*10-7mol/L=1.0*10-10mol/m3
在超纯水极限状态下,其电导率G∞[H20]=G∞(H+)*[H+]+G∞(OH-)*[OH-],
此处浓度单位是mol/m3
G∞(H+):氢离子极限摩尔电导率,25℃时,其值为349.82S·m2·mol-1
G∞(OH-):氢氧根离子极限摩尔电导率,25℃时,其值为198.3S·m2·mol-1
通过计算G∞[H20]=349.82*10-10+198.3*10-10=538.22*10-10S/m=0.054812μS/cm
此时我们计算极限电阻率R=1/G=18.24418MΩ*CM,数值非常接近18.3,但是还是有偏差,原因是什么呢?
因为我们在计算时犯了一个常识性的错误,默认水的密度为1g/cm3。在精密计算时,这是不可忽略的因素,下表为不同温度下的水密度,我们取值0.997074。
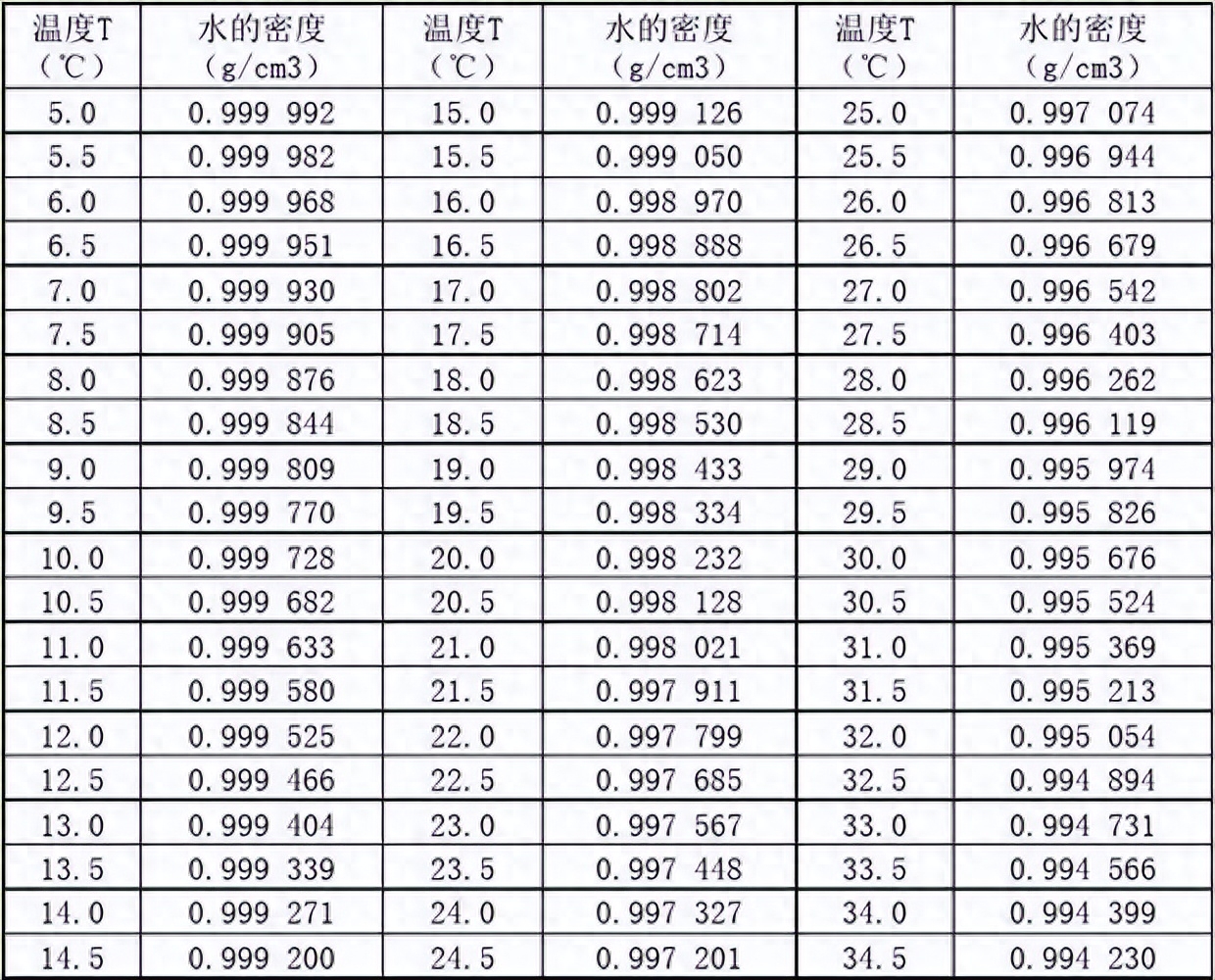
当我们默认水密度为1(省略单位,下同)时,单位体积的离子浓度是超过实际单位体积下离子浓度的。也就是在25℃时,单位体积的离子浓度实际不是1.0*10-10mol/m3,而是0.997074*10-10mol/m3,所以实际的G∞[H20]=(349.82+198.3)*0.997074*10-10=0.05465162μS/cm,
R=1/G=18.2977MΩ*cm≈18.3MΩ*cm,这就是25℃时超纯水电阻率极值的由来。
那么温度对极限超纯水的电导率和电阻率到底有多大影响,是否是线性相关性呢?
溶液的电阻随温度而降低,电导随温度的升高而升高,一般溶液的电导率增加幅度为2%(每℃)。在低浓度时
溶液电导率存在关系式G1=G0[1+α(t-t0)+β(t-t0)2]≈G0[1+α(t-t0)],其中下标0为25℃标准状态,t0=25。
对于极限状态下的超纯水而言,H+和OH-的温度系数分别为1.5%(每℃)和1.8%(每℃),通过温度系数的调整,我们简单计算一下在15℃和30℃时,超纯水的极限电导率和电阻率。
15℃时,G=349.82*0.85*0.997074+198.3*0.82*0.997074=0.04586072μS/cm,极限电阻率R=21.8052MΩ*cm。
30℃时,G=349.82*1.075*0.997074+198.3*1.09*0.997074=0.05922035μS/cm,极限电阻率R=16.886MΩ*cm
也就是在不同温度下18.3的电阻率并不是其实际的理论极限值,但是目前市场上的电阻率和电导率表都会自动校准换算到25℃时,省去了大家换算和比较的麻烦。
延伸一个小问题:电阻率要求≥18MΩ*cm的超纯水系统一般不设置终端超纯水箱。
此类系统一般在EDI出水端设置超纯水箱(电阻率≥15MΩ*cm),经过抛光树脂装置和终端过滤器以后直接对接使用点,或者接入循环管道。因为超纯水是极其敏感的存在,其短暂储存或者接触空气都有可能受到“污染”。
我们假设刚制备的极限超纯水,短暂接触空气(假定1%可溶性二氧化碳融入超纯水),此时系统会发生以下情况:
H2CO3=(H+)+(HCO3-),K=4.30*10-7,25℃时(忽略二级电离平衡)
前文我们介绍过饱和二氧化碳的溶解度为0.033mol/L(0.145g/100ml),根据亨利定律在自然条件下,在空气中占比为0.031%,当其中1%快速融入超纯水时(假定极低浓度下完全电离),其溶解度为0.033*0.031%*1%=1.023*10-7mol/L
原本超纯水中[H+]=1.0*10-7,新的平衡进入以后,K=4.3*10-7,[H2CO3]=1.023*10-7
通过计算我们得到平衡后的[H+]=2.6561*10-7mol/L,[HCO3-]=1.6561*10-7mol/L,[OH-]=0.3765*10-7mol/L
此时电导率G∞=(349.82*2.6561+198.3*0.3765+52*1.6561)*0.997074=0.10899341μs/cm
同理R=9.175MΩ*cm,短暂接触就会出现超纯水电阻率急剧下降的情况,这跟现实基本保持一致。实践证明15MΩ*cm以上的超纯水暴露在空气中1分钟后水质就会下降至3-4MΩ*cm,3分钟以后就会下降到2MΩ*cm左右。
此时pH=-lg[H+]=6.5758呈弱酸性,过几分钟此数值将进一步降低直到5.6左右,此时超纯水完全被空气污染。

浙江新伟环保设备有限公司是一家专业从事水处理工程设备研制、生产、销售及施工为一体的技术型企业,业务范围涉及给水处理,工业纯水和超纯水处理和生活、工业废水处理。